U R O M A S T Y X (Merrem, 1820)
par OLIVIER ANTONINI
bebesaurus@wanadoo.fr
www.bebesaurus.fr.st

|
Tableau 1 Classification
GROUPE DES ACANTHINURA1.
Uromastyx acanthinura acanthinura (BELL,
1825) Algerie, Tunisie, Lybie Uromastyx acanthinura nigriventris (HARTERT, 1913) Sud-Ouest du Sahara algerien,
Maroc,
Mauritanie 2.
Uromastyx dispar dispar (HEYDEN, 1827) Soudan, Tchad
Uromastyx dispar flavifasciata (MERTENS, 1962) Sahara Occidental
Uromastyx dispar maliensis (JOGER & LAMBERT, 1996) Mali,
Sud-Ouest de l’Algerie 3. Uromastyx
geyri (MULLER, 1922) Sud
de l’Algerie, Mali, Niger (montagne
d’Hoggar) 4. Uromastyx
alfredschmidti (WILMS & BOHME, 2000) Ouest de la Lybie et Sud de
l’Algerie GROUPE DES AEGYPTIA 5. Uromastyx
aegyptia aegyptia (FORSKALL, 1775)
Egypte (à l’est du
Nil), Soudan, Israel Uromastyx aegyptia microlepis
(BLANFORD, 1874) Nord de
l’Arabie Saoudite, Israel, Syrie,
Irak, Iran, Jordanie 6.
Uromastyx leptieni (WILMS & BOHME 2000) Oman, Emirats Arabes
Unis 7. Uromastyx occidentalis (MATEO & BONS, 1999)
Sahara Occidental UROMASTYX
D’IRAN 8. Uromastyx
asmussi (STRAUCH, 1863) Iran, Afghanistan, Pakistan UROMASTYX INDIEN 9. Uromastyx
hardwickii (GRAY, 1827) Pakistan,
Sud-Est de l’Afghanistan, Nord
de l’Inde UROMASTYX D’IRAK 10.
Uromastyx loricata (BLANFORD, 1874) Irak, Iran GROUPE DES OCELLATA 11.
Uromastyx benti (ANDERSON, 1894) Yemen,
Oman, Sud de l’Arabie Saoudite 12.
Uromastyx ocellata (WERMUTH, 1967) Nord-Ouest de
la Somalie, Djibouti,
Erythrée, Nord du Soudan, Sud de l’Egypte 13.
Uromastyx ornata ornata (HEYDEN, 1827) Est de l’Egypte, Israel,
Arabie Saoudite
Uromastyx ornata philibyi (PARKER,
1938) Arabie
Saoudite, Yemen 14.
Uromastyx macfadyeni (PARKER, 1932) Nord-Ouest de
la Somalie UROMASTYX DE SOMALIE 15.
Uromastyx princeps (O’ SHAUGNESSY, 1880) Ethiopie, Somalie,
Est du Kenya, Zanzibar UROMASTYX D’OMAN 16.
Uromastyx thomasi (PARKER, 1930) Oman,
Yemen, Sud de l’Arabie Saoudite |

Le genre Uromastyx (MERREM, 1820) fait partie de la
famille des Agamides et de la sous-famille des Uromastycinae.
Selon la nouvelle classification proposée par Thomas Wilms et Wolfgang Böhme en 2001, il comprend 16 espèces et 9 sous-espèces (voir Tableau 1).
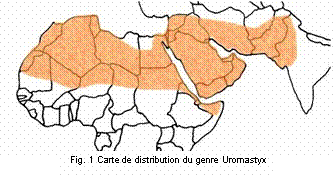 La zone de repartition de Uromastyx
est une zone très étendue qui, à partir du Sahara occidental, traverse tout le
Nord de l’Afrique, le Moyen Orient, l’Irak, l’Iran, le Sud de l’Afghanistan, le
Pakistan jusqu’au Nord-Ouest de l’Inde (voir Fig. 1).
La zone de repartition de Uromastyx
est une zone très étendue qui, à partir du Sahara occidental, traverse tout le
Nord de l’Afrique, le Moyen Orient, l’Irak, l’Iran, le Sud de l’Afghanistan, le
Pakistan jusqu’au Nord-Ouest de l’Inde (voir Fig. 1).
Uromastyx, appelé « dob » en arabe et
« fouette-queue » en français en raison de la manière de se défendre
en fouettant avec sa queue épineuse, est un lézard herbivore, terrestre,
sédentaire, diurne et héliophile.
Il occupe les biotopes pierreux et rocheux des milieux désertiques tandis qu’on ne le trouve pas sur les terrains sabloneux qui constituent des barrières à ses déplacements.
Toutes les espèces de Uromastyx sont
classées en ANNEXE II de la Convention internationale sur les espèces en
danger (Convention on International Trade in Endangered Species, C.I.T.E.S.)
dite aussi "Convention de Washington". Les individus prélevés dans la
nature doivent être donc vendus avec un numero de CITES. Ceci permet de
contrôler le commerce international de cette espèce qui est considerée comme
relativement menacée dans son habitat naturel.
L’importation des Uromastyx
en Europe occidentale est limitée seulement à certaines espèces qui sont donc
plus connues que d’autres par leur détention et reproduction en captivité.
A ma connaissance, on peut se procurer, avec plus ou moins de facilité, en France, Uromastyx acanthinura nigriventris, Uromastyx dispar maliensis, Uromastyx dispar flavifasciata, Uromastyx geyri, Uromastyx aegyptia aegyptia, Uromastyx ocellata, Uromastyx ornata ornata et Uromastyx hardwickii.
Les notes qui suivent concernent la maintenance de six espèces d’Uromastyx :
ê Uromastyx acanthinura nigriventris
ê
Uromastyx dispar maliensis
ê
Uromastyx geyri
ê
Uromastyx aegyptia aegyptia
ê
Uromastyx ocellata
ê
Uromastyx hardwickii
Parmi ces espèces, quatre ont été reproduites
au cours des trois derniers années dans les locaux de l’association Bébésaurus,
c’est-à-dire : U. a. nigriventris, U. d. maliensis, U. geyri et
U. ocellata.
Aménagement du terrarium
Les dimension du terrarium varient selon la
taille et l’âge des animaux.
Un couple reproducteur de taille moyenne (U. acanthinura, U.
d. maliensis, 35-40cm environ) ainsi que les petits
groupes (3 ou 4 individus) d’Uromastyx de petites taille (U. ocellata,
30cm maximum) ou de taille moyenne (U. hardwickii, U. geyri, 35cm
environ) sont logés dans des terrariums qui ont une surface au sol de 100x100cm
ou 180x50cm.
Les deux groupes de 3 individus U. a. aegyptia, Uromastyx de grande
taille (70-75cm maximum) sont logés dans des terrariums de 200x100cm.
Les juveniles (20-25cm) sont logés seuls dans des terrariums 100x50cm.
Quand cela est possible, une bonne profondeur sera privilegiée car les Uromastyx
se sentent plus en sécurité s’ils ont du recul par rapport à
l’"exterieur".
La hauteur des terrariums varie entre
50cm et 60cm. Ceci permet d’aménager grâce au décors (souche, écorce de liège…)
un endroit prés du néon (30cm maximum), là où les lézards peuvent
profiter du rayonnement UVA et UVB. Généralement, Uromastyx ne grimpe
pas sur les branches, sauf pour U.
ocellata ou pour les juveniles.
Sur les côtés du terrarium ou au plafond
il y a des aérations grillagées (mes terrariums sont en bois sur
les trois côtés, avec des vitres sur glissières devant) afin qu’il y aie un
changement d’air suffisant et empêcher la surchauffe du terrarium.
Sur un côté du terrarium je met un spot de 60W (ou une lampe à vapeur de
mercure mixte de 160W pour les terrarium 200x100cm) à 20cm du sol et avec une
pierre plate au-dessous de manière à créer un point chaud qui atteint
45°C-50°C. Au point le plus frais, au côté opposé, la température sera de 28°C
environ. Un bon gradient thermique est très important car il permet à l’animal
de régler sa température interne par des adaptations comportementales qui lui
sont propres. Ainsi qu’il le fait dans le milieu naturel, Uromastyx se
chauffe, le matin, par rayonnement en se dressant sur les pattes anterieures,
le dos vers la source de chaleur. Cependant, en captivité on peut souvent
observer l’animal se chauffer aussi par conduction en s’aplatissant sur la
pierre situé sous le spot. Quand il a atteint sa température optimale il
s’eloigne de lui-même vers le point le plus frais du terrarium. S’il n’arrive
pas à baisser suffisamment sa température interne [c’est-à-dire si elle reste
superieure à 39°C en milieu naturel (Grenot,
1976)], Uromastyx manifestera son état par une
ventilation rapide en ouvrant la bouche (polypnée thermique), ce qui
represente un moyen de
refroidissement par évaporation bucco-pharyngée (Grenot & Loirat,
1973).
Selon la saison et la température de la pièce, je met en place un tapis
chauffant (Habistat®) qui, à la difference des câbles chauffants ne peut pas
être aisement déterré.
Une forte luminosité et une chaleur importante sont essentiels pour une
maintenance correcte de Uromastyx en captivité. Ces données sont
maintenues constantes pendant la durée du jour qui sera de 14 heures au
maximum en juillet-août et de 8 heures au minimum pendant la periode
d’hivernage (voir chapitre sur la reproduction).
Les juvéniles sont chauffés par un petit spot
de 40W : leur besoin de chaleur est sensiblement le même que celui des
adultes.
La nuit le chauffage est coupé et la
température du terrarium redescend à la température de la pièce qui varie,
selon les saisons, entre 15°C et 30°C.
Pour le substrat, après avoir presque tout essayé et avoir aussi
perdu un individu par occlusion intestinale causée par un éclat d’hêtre, j’ai
opté pour le Litalabo®, ce sont des minuscules copeaux de bois conçus pour les
cobayes qui, même s’ils sont ingerés, ne provoquent pas des bléssures internes
car ils ne sont pas coupant et sont éliminés avec les excréments. Une
idée intéressante nous vient des Etats Unis où certains éleveurs maintiennent leurs Uromastyx sur un substrat
constitué de graines pour oiseaux; pour ce qui me concerne je trouve un tel
aménagement pas vraiment économique ni hygièniqe.
Par contre, je maintiens les nouveau-nés et
les juvéniles jusqu’à 11cm environ sans substrat ou sur du Sopalin, ce qui me
permet aussi de contrôler plus facilement leurs excréments, source de
renseignements sur leur état de santé. Pour la même raison, je garde sans
substrat les animaux malades.
Le décor de
mes terrariums est constitué en premier lieu d’une écorce (ou une tuile), indispensable pour le bien-être
de ces lézards qui s’y cachent quand ils sont stressés ou quand ils dorment.
Cet abri est placé du côté frais du
terrarium. Pour qu’ils s’y sentent en securité, quand ils y sont debout la tête
doit toucher le ‘plafond’ ou, mieux encore, ils ne doivent pas pouvoir s’y
tenir debout. En principe, il doit y avoir une cachette par animal, mais j’ai
constaté que souvent ils dorment dans la même sans problèmes.
Dans le terrarium des adultes reproducteurs je
place une boite de ponte qui est souvent utilisée comme repaire. Il
s’agit d’une bassine 30x40x15cm environ remplie de vermiculite
legèrement humide ; sur le devant de cette bassine j’ai pratiqué une
ouverture ronde de 8 ou 10cm de diamètre dans laquelle j’ai inseré un tuyau
flexible (tuyau de VMC) long de 40-50cm qui represente le "tunnel"
d’accés à la "chambre de ponte". Cette dernière est ensuite fermée
avec une plaque en PVC ou avec une autre bassine rétournée.
Une souche assez grande pour permettre aux
animaux de s’approcher du néon installé au plafond et qui peut être escaladée
facilement –ou une écorce
qui monte vers le néon– constitue la
dernière pièce indispensable de mon décor. Selon la place à disposition,
j’ajoute également des cactus en plastique, des cailloux, parfois des
branches, en prennant toutefois garde à qu’il y aie toujours un espace ouvert
suffisant pour permettre aux lézards de se deplacer aisement et notamment de
s’accoupler.
Etant donné la puissance que ces lézards ont
dans leurs machoires et la capacité coupante de leurs dents, j’évite les
plantes en plastique, dont les feuilles peuvent être ingerées, ainsi que
n’importe quelle plante véritable. Je fais aussi attention à que les
élements du décor ne soient pas simplement appuyés sur le substrat mais qu’ils
touchent le fond du terrarium car en creusant les Uromastyx risquent de
se faire écraser par la souche, les pierres etc. (en particulier les juveniles
et les animaux de petite taille).
Tous les deux mois je change le substrat et
je passe tout, y compris le decor, à l’eau de javel.
Alimentation en captivité
Uromastyx est un lézard herbivore.
En terrarium son menu de base comprend en
premier lieu des végétaux, notamment de la salade et des légumes, qui
seront distribués quotidienement.
Les salades que je leur donne sont de préférence celles qui ont un bon rapport
phospho-calcique (deux fois plus de calcium que de phosphore), donc la scarole,
la mâche, la chicorée, le cresson, la frisée, la romaine, les endives, les
blettes, les feuilles de navet, le pissenlit, le trèfle, la luzerne. Salon la
saison, je leur propose également les feuilles de robinier et de "mûrier-platane".
Les fleurs aussi constituent un mets
de choix, par exemple les fleurs de pissenlit, de trèfle, de robinier, de courgette,
d’hibiscus, de forsythia.
Avec la salade je
leur donne aussi un parmi ces légumes : haricots verts, petits pois,
courgettes (vendus congelés en sachets et préalablement décongelés), carottes
crues rapées ou partiellement cuites, choux de bruxelles, lentilles
(réhydratées), pois chiches (réhydratés), pois cassés (réhydratés), haricots
mungo (réhydratés).
Pour ce qui concerne les fruits, je dois dire que mes
Uromastyx ne les aiment pas, sauf peut-être les figues et les figues de
barbarie. Mais c’est vrai aussi que les goûts changent d’un individu à
l’autre et que leurs préférences changent avec le temps. D’ailleur, n’importe
quelle nourriture peut être refusée aujourd’hui et appreciée demain.
Régulièrement, une fois par semaine environ,
je leur prépare une coupelle de graines (30 gr environ) que je melange
avec du carbonate de calcium. A la différence des salades et des légumes que je
donne indifférement aux adultes et aux juvéniles (ce qui change est évidemment
la taille des ‘morceaux), les graines ne sont pas les mêmes selon l’âge de
l’animal. Pour les juvéniles (à partir de 12cm de taille) : lin doré et
brun, quinoa, millet, alfalfa (c’est-à-dire graine de luzerne), tandis que le
sarrasin est distribué aux jeunes de plus de 20cm. Pour les adultes : blé,
orge decortiqué, sarrasin, tournesol, cacahouètes non grillées pour perroquets,
ainsi que les graines des juvéniles. Aux bébés je ne donne pas de graines par
crainte d’occlusion intestinale.
Etant donné le comportement des mes Uromastyx, ces graines ont vite fait de se retrouver éparpillées partout
et mélangées au substrat : ça leur permet de se constituer une ‘réserve’
de nourriture, avec des morceaux de légumes ou de salade séchés, qu’ils
déterrent par des mouvement vifs des pattes. En fait, même si j’enlève tous les
jours le plus gros de la nourriture non consommée, on ne peut empêcher que des
débris de ces aliments restent mélangés aux copeaux : mais l’environnement
sec dans lequel je les maintiens évite qu’ils pourrissent et ils peuvent donc
être consommés (d’ailleurs j’ai remarqué que parfois les Uromastyx les
prefèrent aux aliments frais).
La salade et les légumes sont saupoudrés avec
du carbonate de calcium trois fois par semaine (tout les jours pour les
juvéniles et les femelles en phase de reproduction), tandis qu’une fois par
semaine (deux pour les jeunes) j’ajoute à la nourriture des vitamines
avec un melange de ‘Sofcanis® croissance’
(complement vitaminique pour chiots) et de vitamines pour oiseaux (Ocevital®).
Pour ce qui concerne les insectes, Uromastyx
en captivité mange volontier grillons, criquets, morios ou vers de farine, mais
cette nourriture n’est pas indispensable pour sa bonne santé, en particulier si
on lui donne des protéines végétales (par exemple avec les petits pois ou
les haricots verts); il y a même des éleveurs des USA qui ont maintenu
leurs Uromastyx, adultes et juvéniles, pendant des années sans
leur donner aucun insecte. En outre, chez les adultes, une nourriture trop
riche en proteines animales risque de provoquer des maladies hépatiques qui
peuvent causer la mort du lézard végétarien, un risque moins important pour les
juvéniles ou les femelles en période de reproduction qui ‘recyclent’ l’excès de
proteines animales dans la croissance ou la production des œufs. La
distribution des insectes sera donc occasionnelle, deux fois par mois environ,
plus frequente pour les femelles gravides ou qui viennent de pondre et pour les
juvéniles. Des insectes toujours saupoudrés de carbonate de calcium et de
vitamines et bien nourris par mes soins. En sachant toutefois que certains des
mes Uromastyx ne les apprecient guère, notamment les U. aegyptia
aegyptia, tandis que les U. ocellata et U. harwickii en
raffollent. Je me suis aussi ‘appuyé’ sur les insectes pour démarrer les
nouveau-nés, petits grillons et vers buffalos : apparemment le mouvement
des proies excite les bébés.
Compte tenu de son aire de distribution, Uromastyx ne boit pas d’eau libre
en milieu naturel. En captivité, j’ai remarqué que seulement les femelles
gravides ou ayant récemment pondu, les nouveau-nés, les animaux fraîchement
importés ou malades buvaient systématiquement. Dans ces cas je leur mets à
disposition une coupelle plate d’eau. Certains éleveurs préconisent une legère
vaporisation matinale dans un coin du terrarium (Wilms, 2002) : pour ce qui me concerne, je ne le fais
pas en craignant que cela puisse entrainer une hygrometrie trop importante dans
le terrarium. Dans le cas d’animaux déshydratés (cas courant chez les individus
nouvellement importés), avec la peau rèche ou des graves problèmes de mues, je
leur fais prendre un bain quotidienement pendant quelques jours.

Comportement en captivité
Le comportement des Uromastyx en captivité
varie d’un individu à l’autre et, surtout, s’il s’agit d’un animal né en
captivité ou sauvage, déjà acclimaté ou de récente aquisition, bien nourri et
bien chauffé ou stressé et malade. Mais, en règle générale, à partir de mon
expérience, je pense que l’idée qu’il s’agit d’un lézard farouche, qui passe sa
journée caché, qui essaye de mordre dès qu’on le touche et que de toute façon
on ne peut pas manipuler, est fausse. Ce que j’ai constaté c’est qu’au
contraire Uromastyx, surtout s’il est né en captivité, est un lézard
très curieux qui regarde avec intêret tout ce qui se passe autour de lui, en
général il peut être manipulé sans que cela provoque un état de stress tandis
qu’il faut éviter de le contenir, la contrainte étant mal supportée par
l’animal.
Une
fois dépassée la crainte de l’homme –crainte
qui, quand elle existe, influence négativement le comportement du lézard– Uromastyx est un sujet ideal d’observation. Ceci est
encore plus vrai si on maintient un couple ou un groupe car le comportement interspecifique
est très varié selon la saison, et particulièrement interessant à la saison des
accouplements.
D’une manière générale, parmi les espèces de Uromastyx
que je posséde, U. acanthinura et U. dispar maliensis seront
maintenus en couple. Sur la base de mon experience, j’ai remarqué qu’il existe
une incompatibilité entre mâles ainsi qu’entre femelles de ces espèces. En
fait, non seulement les mâles se ‘bagarrent’ mais les femelles aussi peuvent
être agressive entre elles, notamment avant et après la ponte. Les morsures ne
sont pas mortelles en soi, c’est-à-dire qu’en générale ils ne s’arrachent pas
des morceaux de chair, ne s’etripent pas, souvent ils ne saignent même pas.
Pour ce que j’ai pu constater, deux cas de figure peuvent se presenter :
ou les deux ‘bagarreurs’ se tiennent tête ou un des deux s’avoue vaincu et
s’échappe sous la cachette la plus proche.
Dans le premier cas ils se font face en
élargissant et applatissant leur corps, ils tournent en rond ‘en biais’ en
montrant ainsi le dos large et rond et ils se mordent mutuellement sur les côté
ou aux cuisses, à l’épaule, à la queue, et, en gardant fortement prise, ils
essayent de renverser l’adversaire. Ce qui veut dire que non seulement ils se
pincent avec leur ‘bec’ puissant mais la peau pincée est ‘vrillée’ avec des
brusques mouvement de tête. Ces batailles peuvent durer longtemps, jusqu’à ce
qu’un parmi les adversaires s’enfuit, et même si les blessures ne paraissent
pas graves sur le coup, par la suite sous la peau meurtrie se developpent des
abcès qu’il faut s’empresser de soigner pour empecher qu’ils evoluent en
septicemie (favorisée par l’état de stress profond qui suit l’affrontement).
Finalement, là où la peau a été meurtrie les écailles ne repoussent pas et
pendant longtemps il reste une peau lisse et blanche pas très reptilienne!
Dans le deuxième cas de figure, le plus
faible ne se bat pas mais il n’a pas de repit non plus, contraint à rester
caché il se nourrit peu et mal, ne se chauffe pas et le stress continu dans
lequel il vit affaiblit son organisme en ouvrant la voie à diverses maladies.
Au contraire, les couples vivent ensemble
sans trop se disputer, je les sépare seulement une semaine avant la ponte pour
permettre à la femelle de pondre tranquillement et éviter d’eventuels dommages
aux œufs. Les seuls problèmes que j’ai constaté concernent éventuellement
l’insistance avec laquelle le mâle essaye de s’accoupler : si la femelle
n’est pas réceptive elle peut "stresser" au point de ne plus vouloir
sortir de son repaire. C’est à l’éleveur d’évaluer si le mâle peut rester dans
le terrarium ou s’il doit être momentanément isolé.
Parmi les autres espèces, les U. ocellata peuvent
(sauf exceptions) être maintenus "en harem", un mâle avec deux ou
trois femelles. Il arrive de temps en temps que les femelles montrent une
certaine agressivité entre elles mais il s’agit d’escarmouches pas vraiment
serieuses. Bien evidement l’éleveur devra toujours rester vigilant afin qu’il
n’y aie pas de changements dans le comportement qui débouchent en combats
dangereux pour l’animal.
Les U. a. aegyptia sont maintenus
aussi "en harem", un mâle pour deux femelles, mais jusque–là les femelles ne sont pas toutes sexuellement
matures : je ne peux pas affirmer qu’il n’y aura pas d’affrontement entre
elles à la saison de la reproduction.
Pour ce qui concerne les U. hardwickii, je
maintien depuis huit mois quatre individus ensemble mais je n’ai pas encore su
les sexer : je ne peux donc pas être affirmatif au sujet de la possibilité
pour les individus de cette espèce de partager le même terrarium pendant la
saison des accouplements. Cependant, dans le milieu naturel U. harwickii a tendance à vivre en colonies (Minton Jr, 1966).
Finalement pour U. geyri j’ai verifié
depuis plus d’un an qu’on peut maintenir les individus de cette espèce en
petits groupes composés de deux ou trois mâles et deux ou trois femelles sans
qu’il se manifeste aucune agressivité interspecifique même pendant la période
des accouplements. De plus, même s’il y a toujours une hiérarchie, tous les
individus évoluent normallement et ils ne souffrent pas de la cohabitation. J’ai
assisté aussi à un ‘accouplement à quatre’, c’est-à-dire que dès qu’un jeune
mâle à commencé à s’accoupler avec une femelle, le plus gros mâle, plus vieux,
est arrivé pour prendre sa place et tout de suite après un deuxième jeune mâle
a aussi tenté sa chance de manière que pendant quelques minutes la femelle
avait trois mâles accrochés sur son dos ! En définitive c’est le plus gros
qui a fini pour s’accoupler. Chez un autre groupe, les deux femelles se sont
accouplées à tour de rôle avec les deux mâles.
Pour ce qui concerne les juvéniles, quand ils
sont maintenus en groupe, ils suivent souvent les mêmes schémas des adultes.
Les jeunes U. acanthinura et U. dispar maliensis peuvent
parfois cohabiter dans le même terrarium pendant un laps de temps mais il
s’agit toujours d’un équilibre instable vite rompu par l’individu qui, en
assumant le rôle de dominant, poursuit d’un bout à l’autre du terrarium ses
petits frères et sœurs en leur mordant les flancs et la queue. Ainsi il ne
donne plus de repit aux autres en leur ‘volant’ la meilleure place au ‘soleil’,
la plus belle cachette, souvent en les empêchant de s’approcher de la
nourriture. La condition d’individu dominé est dangereuse à plus forte raison
pour un jeunes animal et ne peut être maintenue longtemps. C’est pourquoi je
garde separés les juvéniles dès qu’ils deviennent agressifs entre eux :
j’ai essayé d’éloigner le dominant mais en l’espace de quelques jours un autre
dominant s’impose et le ‘cirque’ recommence.
Au contraire, les juvéniles U. ocellata,
U. a. aegyptia, U. hardwickii et U. geyri ont grandi ensemble sans
problèmes.
Reproduction en captivité
Tout d’abord je veux preciser que mon
expérience dans la reproduction des Uromastyx est très limitée :
j’ai reproduit Uromatyx ocellata en 2000 et 2002, Uromastyx
acanthinura et Uromastyx dispar maliensis en 2001 et 2002, Uromastyx
geyri en 2002. Toutefois, même si, d’après moi, pour une bonne maîtrise de
la reproduction sont nécessaires plusieurs années consecutives de succès, je
pense avoir appris quelques éléments de base qui ont été jusque là confirmés
par des resultats positifs.
hivernage
La première et la deuxième année que j’ai
reproduit mes Uromastyx, je n’ai
pas entamé un veritable processus d’hivernage. N’ayant pas connaissance de
donnés sur ce sujet et en me fondant sur l’idée, fausse, que la reproduction
des Uromastyx en captivité est très difficile voir impossible, j’ai
laissé vivre mes animaux en hiver dans les mêmes conditions que le reste de
l’année hormis une baisse de photopériode (10 heures en hiver, 14 heures en
été). Du moins c’est ce que je croyais…. J’ai été donc très surpris quand, le
27/02/2000 j’ai vu mes Uromastyx ocellata s’accoupler. Avec le recul, en
cherchant les raisons de cet exploit, je me suis rendu compte que le câble
chauffant ne marchait plus depuis au moins un mois et que donc dans le
terrarium il y avait eu une baisse, ni voulue ni maîtrisée, de la température.
Un scenario similaire s’est produit l’année suivante pour une partie des mes Uromastyx
acanthinura et Uromastyx dispar
maliensis, justement ceux qui se sont reproduit en 2001, tandis que
d’autres femelles de la même espèce logées dans un autre terrarium où la température
est restée élevée tout le long de l’hiver, ne se sont pas accouplées.
|
Tableau 2 |
||||
|
Date |
Durée du jour |
Nourriture |
Néon |
Spot |
|
08-sept |
14h |
tous les jours |
allumé |
allumé |
|
15-sept |
13h30 |
tous les jours |
allumé |
allumé |
|
22-sept |
13h |
tous les jours |
allumé |
allumé |
|
29-sept |
12h30 |
tous les jours |
allumé |
allumé |
|
06-oct |
12h |
tous les jours |
allumé |
allumé |
|
13-oct |
11h30 |
tous les jours |
allumé |
allumé |
|
20-oct |
11h |
tous les jours |
allumé |
allumé |
|
27-oct |
10h30 |
tous les jours |
allumé |
allumé |
|
03-nov |
10h |
tous les jours |
allumé |
allumé |
|
10-nov |
9h30 |
3 fois/semaine |
allumé |
allumé |
|
17-nov |
9h |
3 fois/semaine |
allumé |
allumé |
|
24-nov |
8h30 |
arreté** |
allumé |
allumé |
|
01-déc |
8h |
arreté** |
éteint |
allumé |
|
08-déc |
8h |
arreté** |
éteint |
allumé 3h/jour |
|
15-déc |
8h |
arreté** |
éteint |
allumé 2h/jour |
|
22-déc |
8h |
arreté** |
éteint |
allumé 3h/jour |
|
28-déc |
8h30 |
arreté** |
éteint |
allumé |
|
05-janv |
9h* |
tous les jours |
allumé |
allumé + tapis chauffant |
|
*ici on reprend le cycle inverse en ajoutant
une demi-heure de lumière par semaine |
||||
|
23-févr |
12h30 |
tous les jours |
allumé |
allumé + tapis chauffant |
|
14-mars |
13h |
tous les jours |
allumé |
allumé + tapis chauffant |
|
30-avr |
13h30 |
tous les jours |
allumé |
allumé + tapis chauffant |
|
30-juin |
14h |
tous les jours |
allumé |
allumé |
|
** je continue à leur donner à boire |
||||
Fort de cette expérience, et en ayant entre temps
pris connaissance des procédés employées par des éleveurs des USA dans la
reproduction des Uromastyx, j’ai mis au point un schéma d’hivernage
(voir Tableau 2) auquel je me suis tenu au cours des hivers 2001-2002 et
2002–2003.
Pendant les trois semaines ‘critiques’ du
08-déc au 28-déc j’ai multiplié mes observations pour m’assurer que tout se
passait bien et j’ai remarqué qu’en moyenne un jours sur trois mes Uromastyx
sortaient de leur cachette pour se chauffer sous le spot en se retirant dès
que les trois (ou deux) heures étaient écoulées. Un tel procedé (et aussi
parce-que la température ne descendait jamais au-dessus de 15°C, température
minimale atteinte la nuit) permet au lézard de garder sa flore intestinale
indispensable pour digerer les végétaux.
Après cette période les Uromastyx sont
naturellement un peu plus maigres que la normale mais ils n’ont pas souffert de
la baisse de température et ils ont recuperé très vite.
Ce schéma a été appliqué aux adultes Uromastyx
acanthinura, Uromastyx dispar maliensis et Uromastyx geyri.
Les juvéniles de ces mêmes espèces ainsi que
les Uromastyx aegyptia –qui sont trop jeunes pour pouvoir se reproduire– et Uromastyx hardwickii
–qui
n’étaient pas en conditions optimales au début de l’hiver ayant été acquis en
automne– ont tout de même beneficié d’un changement saisonnier, c’est–à–dire la journée de 8 heures ainsi qu’une relative baisse de
température notamment la nuit (mais je n’ai pas éteint ni le néon ni le spot
pendant les 8 heures du jours). Leur comportement d’ailleurs a beaucoup changé
pendant cette période, ils sortaient très peu et ils mangaient très peu aussi
et la croissance des juvéniles s’est arrêtée.
Les Uromastyx ocellata continuent pendant toute la durée de l’hivernage à bénéficier de la chaleur et de la lumière diffusées par les spots et à se voir proposer la nourriture un jour sur deux, mais la luminosité diminue car le néon est éteint. Cette différence de traitement est due au fait que U. ocellata subit à l’état sauvage un hivernage plus doux que les autres espèces du Sahara et du Pakistan. Pour cette espèce (ainsi que pour U. ornata ornata et U. benti) une baisse de température de 5°-10°C en hiver serait suffisante pour stimuler le cycle reproducteur (T. Wilms, 2001).
A ce propos, il faut se rattacher aux observatons de C. Grenot (1976) en milieu naturel : la température, la lumière et l’humidité influent directement sur le cycle sexuel mais ce serait l’augmentation progressive de la photopériode le stimulus principal qui determine le début de l’activité sexuelle. L’abondance en végétaux qui suit les pluies printanières aurait aussi un rôle important dans ce processus.
Si une periode de repos hivernale est
nécessaire pour reproduire le genre Uromastyx, je crois qu’un léger
hivernage est bénéfique à tout âge et independamment de l’objectif de la
reproduction, il permet de marquer le mouvement des saisons et, peut-être,
contribue à reproduire un environnement plus naturel donc plus favorable au
bien-être des animaux en captivité.
Accouplement
Les parades d’accouplement menées par les
mâles se heurtent souvent, au début, à un net refus de la part des femelles. Le
mâle commence par des amples hochements de tête verticaux qui entrainent aussi
les pattes anterieures en donnant l’impression qu’il ‘fait des pompes’. En même
temps il tourne frénétiquement autours de lui-même et au-dessus de la femelle
et il essaye de la mordre sur les côtés, sur le dos, à la nuque. Si elle n’est
pas réceptive, la femelle essaye de s’échapper, une fois attrappée agite
fortement les pattes et, pour être encore plus claire dans son refus, se met
sur le dos, ventre en l’air. Cette position rend impossible l’accouplement et
le mâle, apres avoir valsé en rond inutilement sur le ventre de la femelle, la
laisse tranquille pour essayer de nouveau plus tard.
Quand la femelle est réceptive elle ne
s’enfuit pas face aux avances du mâle et, quand il la pince au cou ou sur le
dos, elle soulève la queue en favorisant ainsi la pénetration d’un des deux
hemipenis du mâle. L’accouplement dure 3–5
minutes, il peut y en avoir plusieurs le même jours (même avec des mâles
differents) et, à ma connaissance, les Uromastyx s’accouplent pendant
environ une semaine, jusqu’à 11 jours, tous les jours.
Tableau 3
|
|||||
|
|
ÂGE |
GESTATION |
NOMBRE D'ŒUFS |
INCUBATION |
TAUX D'ECLOSION |
|
Uromastyx ocellata fem1
2000 |
inconnu |
30 jours |
15 |
83-86 jours |
93,3% |
|
Uromastyx ocellata fem2
2002 NC* |
2 ans |
34 jours |
8 |
89 jours |
12,5% |
|
Uromastyx ocellata fem3
2002 NC |
2 ans |
32 jours |
10 |
Œufs non viables |
0 |
|
Uromastyx acanthinura fem1 2001 NC |
3 ans |
30 jours |
16 |
74-77 jours |
94% |
|
Uromastyx acanthinura fem1 2002 NC |
4 ans |
32 jours |
17 |
76- 79 jours |
58,8% |
|
Uromastyx d. maliensis fem1 2001 |
5 ans environ |
30 jours |
7 |
87-89 jours |
88,8% |
|
Uromastyx d. maliensis fem2 2002 |
6 ans environ |
31 jours |
9 |
91-93 jours |
77,7% |
|
Uromastyx geyri fem1 2002 |
inconnu |
25 jours après l’achat |
8 |
Œufs non viables |
0 |
|
Uromastyx geyri fem2 2002 |
inconnu |
32 jours après l’achat |
7 |
76-80 jours |
42,5% |
|
Uromastyx geyri fem3 2002 |
inconnu |
37 jours après l’achat |
14 |
76-85 jours |
85,7% |
|
Uromastyx geyri fem4 2002 |
inconnu |
36 jours |
7 |
Œufs non viables |
0 |
Gestation
A compter du dernier jour d’accouplement, mes
femelles ont, jusqu’à présent, toujours pondu environ un mois après (voir
Tableau 3). D’une manière générale, il faut compter entre 4 et 6 semaines.
Ponte
Mes Uromastyx
pondent une seule fois par an. Cependant, d’après
certains auteurs (Doumergue,
1901 ; Bons, 1969 ; Wilms, 2001) il pourrait y avoir deux
pontes par an, séparées par une petite période de repos pendant l’été chez U.
acanthinura.
Une semaine environ avant la ponte, la
femelle s’arrête de manger et elle commence à creuser un peu partout, de
manière de plus en plus acharnée à mesure que la date de la ponte approche.
Chez Uromastyx acanthinura et Uromastyx ocellata des renflements
abdominaux peuvent parfois trahir la presence des œufs, mais pas
nécessairement.
D’une manière générale, la femelle accepte le
site de ponte avec lequel elle a déjà eu le temps de se familiariser ;
pour la sécuriser encore plus j’enlève le mâle qui a la facheuse tendance de
‘squatter’ ce pseudo-terrier. Si elle refuse d’y pondre, je vérifie la
température (qui ne doit pas être plus élevée au fond de la boite par rapport à
le surface) et l’hygrométrie (la vermiculite doit être légèrement humide).
Une fois la ponte effectuée, je retire les
œufs en prennant garde à ne pas les retourner et je les place dans
l’incubateur. La femelle continue pendant une, deux semaine à
"protéger" son site de ponte en empechant le mâle de s’y approcher,
en soufflant et en le poursuivant jusqu’aux frontières de ‘son’ territoire.
Les nombre
des œufs pondus varie selon l’espèce, l’âge et la taille (voir Tableau 3).
Incubation
Les œufs sont placés dans une boite avec un
couvercle troué et remplie de tourbe séche ; cette boite est ensuite
placée dans un incubateur où la température est de 31-32°C et l’humidité de
100% environ. Ces données sont maintenues constantes pendant la durée de
l’incubation, en moyenne entre 80 et 90 jours (voir Tableau 3).
Jusque–là, l’incubateur dont je me sers est du genre
"fait–maison" : un vieux frigo débranché et équipé d’un câble
chauffant relié à un thermostat et qui traverse en partie un bac d’eau de la
taille du bac à légumes du frigo. Cela me permet d’avoir un environnement
isolé, saturé d’humidité et à une tempèrature constante : ces données je
les retrouve dans les boites car les couvercles sont trouées. D’autres moyens
peuvent être envisagés, par exemple certains éleveurs (Wilms, 2001) prefèrent incuber les œufs dans une boite fermée
sans aerations et remplie de vermiculite, tout en humidifiant légèrement avec
une seringue la vermiculite au fond de la boite, et en ouvrant celle-ci de
temps en temps pour permettre le renouvellement de l’air.
Quoiqu’il en soit
il est imperatif que les œufs ne soient pas posés sur un substrat humide sous
peine de les voir moisir. En bref : substrat sec dans un environnement
saturé d’humidité.
En 2000 et en 2001 j’avais remarqué que,
quelques jours avant l’éclosion, les œufs commencaient à ‘perler’, c’est-à-dire
que des goutelettes se formaient sur la surface. Par contre, en 2002 les œufs
ont commencé à se dégonfler une semaine-dix jours avant l’éclosion et il n’y a
pas eu des goutelettes.
Naissance
Les naissances sont echelonnées sur 3, 4 jours.
Le taux d’éclosion varie entre 60% et 80%
(voir Tableau 3) en comptant également les œufs non fécondés.
Les
nouveau-nés U. acanthinura et U. d. maliensis mesurent 8–9cm environ de longeur totale
pour 6gr environ de poids; les nouveau-nés U. geyri et U. ocellata sont un peu plus petits, 7–8cm environ de longeur totale
pour 3.5–4.5 gr environ de poids. Ils sont tout de suite bien vifs et ils
commencent à manger deux, trois jours après la naissance.
La croissance est relativement importante les
premiers mois. Ensuite, dès que la photopériode diminue, elle ralentit
considerablement et elle s’arrête en novembre–décembre. Avec le retour de
la "bonne saison" la croissance reprend avec vigueur : à l’âge
d’un an, par exemple, les jeunes U. acanthinura mesurent 20cm environ
pour 85gr de poids, alors que les jeunes U. d. maliensis mesurent 18cm
environ pour 50gr de poids.
Une mésaventure qui a frappé les premiers
mois de vie de mes petits Uromastyx en 2001 est riche en enseignements. Dans
un texte d’éleveurs américains j’avais lu qu’ils donnaient à manger à leurs
nouveau-nés les excréments des parents : ceci me paraissait sensé car ce
genre de ‘nourriture’ favorise la création de la flore intestinale et cette
pratique est courrante dans la nature chez les animaux végétariens (Iguana
iguana, entre autres, mais aussi chez certains mammifères comme le koala).
Malheureusement, quelques jours après avoir ainsi nourri mes bébés Uromastyx,
certains d’entre eux ont commencé a avoir la diarrhée et 10 sont morts avant
d’avoir pu être soignés. L’année suivante je n’ai pas répeté l’expérience et
les jeunes ont grandi normallement. Par contre, le fait que pendant les deux
premiers mois de vie ils mangent systématiquement leur propres excréments ainsi
que ceux de leurs frères et sœurs n’a pas d’effets négatifs sur leur santé.
Maladies et
soins
Si je me refère à mon expérience, je peux
dire que dans l’ensemble Uromastyx est un lézard robuste :
-
quand
il est maintenu en des bonnes conditions de température et d’hygrometrie ;
-
quand
il est bien nourri (végétaux variés et très peu d’insectes, vitamines et
calcium en des proportions adéquates) ;
-
quand
on lui donne des UVB, des UVA et une bonne luminosité ;
-
quand
il évolue au rythme correct des saisons pour ce qui concerne la durée du jour
et les changements de température jour-nuit ;
-
quand
il est maintenu sur un substrat qui ne peut pas lui causer une occlusion
intestinale dans le cas, frequent, d’ingestion accidentelle ;
-
quand
il est entouré d’un décor qui tient compte de sa nature de ‘creuseur de
terriers’ et ‘mangeur de plantes’ ;
-
quand
il n’est pas soumis à des situations de stress continu (dominance voir
agression de la part de ses congenères).
Il faut toutefois faire la difference entre
un animal né en captivité et un animal fraîchement importé. Ce dernier arrive
avec déjà un parcours de capture-stokage-transport etc. qui l’a affaibli et
rendu très vulnérable aux maladies. C’est donc à l’achat que je ‘trie’ pour
avoir le maximum de chance d’avoir un lézard qui s’adaptera à la captivité et,
de plus, se reproduira. Je n’achète donc pas des Uromastyx trop maigres
(en regardant notamment la queue), qui ont un ‘regard éteint’, des abcès, des
graves problèmes de mue, des résidus de diarrhée au cloaque, du mucus dans la
bouche (symptôme de problèmes respiratoires)…..
Les animaux d’importation sont souvent parasités,
ce qui peut ne pas être evident au coup d’œil. Il faut donc procéder au
déparasitage, sous contrôle de votre vétérinaire, notamment avec du Flagyl® car les amibes sont parmi les parasites les plus
fréquemment rencontrés chez les Uromastyx. Le Panacur® est aussi un bon vermifuge contre les oxyures présentes en
grande quantité dans leur tube digestif. Une thérapie qui doit être éffectué
d’urgence si le lézard présente des symptômes de diarrhée ou de sang dans les
selles.
Pour lui faire prendre un éventuel traitement
par voie orale (et aussi pour regarder s’il n’a pas une stomatite), le
principal problème est de reussir à lui ouvrir la gueule, car il possède une
force impressionante dans la machoire.
Une méthode que j’emploie consiste à lui
‘chatouiller’ avec le pouce et l’index les coins des lèvres avec un mouvement
doux mais repetitif de va-et-vient. Ca marche la plupart du temps et c’est la
seule manière d’y arriver sans dommages car en forcant on risque de lui casser
des dents ou de le blesser, ce qui peut entrainer par la suite une stomatite
très dangereuse.
Les maladies respiratoires sont parmi
les plus courantes chez les Uromastyx, il suffit parfois d’une baisse
trop importante de température ou d’un courant d’air. Pour soigner ce genre
d’infection il faut employer des antibiotiques que votre vétérinaire vous
prescrira. Ce que je veux faire remarquer à ce sujet est que si votre vétérinaire
n’est pas un spécialiste des reptiles vous devez lui dire qu’il s’agit d’un
lézard végétarien afin qu‘il ne lui donne pas des antibiotiques à spectre large
qui risquent de detruire sa flore intestinale.
J’ai aussi eu à faire à des problèmes de
mue, c’est-à-dire que pendant la mue (qui peut se derouler sur plusieurs
jours ou semaines) la peau devient rèche et ‘s’effrite’ en lambeaux
minuscules ; dans ce cas je lui fait prendre un bain d’eau tiède et je le
badigeonne avec une pommade hydratante, comme la Biafine®.
Un autre problème auquel j’ai été confronté
est relatif au fait qu’il s’agit de lézards qui sont ‘programmés’ pour creuser
tout le long de leur vie dans des terrains souvent durs et pierreux, donc ils
ont les ongles adaptés pour cela. En captivité, cette activité étant très
reduite, les ongles poussent de manière anormale, ils peuvent donc se casser en
provoquant des panaris ou des abcès ou encore il peut y avoir des déformations
des doigts. J’ai par conséquent pris l’habitude de couper regulièrement les
ongles de mes Uromastyx.
J’ai aussi observé que chez certains individus
(souvent nés en captivité) se formaient des petites croûtes jaunâtres sur les
lèvres : un problème qui doit être traité avec une pommade antibiotique
tandis que mes tentatives de nettoyer la croûte avec du désinfectant
n’apportaient aucun changement, sinon le risque d’enlever des écailles.
Conclusion
Vu l’aire de répartition des Uromastyx,
il est facile de recréer des conditions de maintenances adéquates pour non
seulement pouvoir les maintenir mais aussi pour les amener à se reproduire. En
effet, il est beaucoup plus facile de pouvoir statisfaire des besoins important
en chaleur, que le contraire (les systémes de refroidissements sont onéreux et
mal adaptés à la terrariophilie). De plus, Uromastyx est herbivore ce
qui simplifie encore sa maintenance.
Encore trop peu sont reproduit en captivité
en France, il serait souhaitable qu’un nombre plus élevé de personne s’adonne
dans l’avenir à l’élevage de ce lézard au comportement si captivant.
Références
ê
A. Bouskila The burrows of the dabb-lizard, Uromastyx aegyptius Israel Journal of Zoology 32(2-3), 1983[1984]: 151-152
ê
H. Bringsoe Observations
on growth and longevity in Uromastyx aegyptia (FORSSKAL, 1775) in the Negev
Desert, southern Israel (Reptilia: Sauria: Agamidae) Faunistische Abhandlungen 21, 1998: 19-21
ê
A. Dubuis, L. Faurel, C. Grenot, R. Vernet Sur le régime alimentaire du Lézard saharien Uromastyx
acanthinurus Bell. C. R. Acad. Sc. Paris, t. 273, p. 500-503
1971
ê
W. J.
Foley, A. Bouskila, A. Shkolnik, I. Choshniak Microbial digestion in the
herbivorous lizard Uromastyx aegyptius (Agamidae) Journal of Zoology
(London) 226(3), 1992: 387-398
ê
C. Grenot Etude comparative de la résistence
à la chaleur d’Uromastyx acanthinurus et de Varanus griseus. La Terre
et le Vie, 4 : 390-409, 1968
ê
C. Grenot Ecophysiologie du Lézard saharien Uromastyx
acanthinurus Bell, 1825 (agamidae herbivore) Ecole
normale supérieure - publications du laboratoire de zoologie
n° 7, 1976
ê C. Grenot
Polymorphisme chromatique du lézard agamide Uromastyx acanthinurus Bell dans les populations du
Sahara Nord Occidental Bulletin de la
Societé Zoologique de France, Tome 99, n° 1, 1974
ê
C. Grenot & F. Loirat L’activité et le comportement thermoregulateur du lézard
saharien Uromastyx acanthinurus Bell.
La
terre et le vie, Revue d’Ecologie Appliquée vol. 27, 1973
ê
C. Grenot & R. Vernet Sur
une population d’U romastyx acanthinurus Bell. Isolée au milieu du Grand
Erg Occidental. C. R. Acad.
Sc., 276 (s r. D) : 1349-1352, 1973
ê
C. Grenot & R. Vernet Les Lézards héliophiles du Sahara : facteurs
écologiques et conditions d’élevage. Bull. Soc.
Hist. Nat. Afr. N., 64 (1-2) : 53-78, 1973
ê C.
Grenot & R. Vernet Rythme
d’activité et régulaton thermique des Lézards sahariens Bull. Soc. Ecophysiol., 2 (1) :
54–56, 1977
ê
U. Joger & M. R. K. Lambert Analysis of the herpetofauna of the Republic of Mali, 1. Annotated
inventory, with description of a new Uromastyx (Sauria: Agamidae) Journal of
African Zoology 110(1) 22 May 1996: 21-51
ê
J. A. Mateo, P. Geniez, L. F. Lopez-Jurado & J.
Bons
Chorological analysis and morphological
variations of Saurians of the genus Uromastyx (Reptilia, Agamidae) in western
Sahara. Description of two new taxa Revista Espanola de Herpetologia 12, 1998: 97-109
ê
G. Matz, M. Vanderhaege Guide du Terrarium
Delachaux et Niestle 1978, 1990
ê
S. A.
Minton, Jr. A contribution to the herpetology of West Pakistan Bulletin
of the American Museum of Natural History
vol. 134: art.
2 , 1966
ê
C. Seshadri Water conservation in Uromastyx
hardwickii (Gray), with a note on the presence of mullerian duct in the
male. Journal of the zoological
society of India vol. 9 N° 2,
p.103-113, 1957
ê
T. Thatcher The Ecology
and Captive Maintenance of Uromastyx Species (Family Agamidae) Reptiles:
Proceedings of the 1988 U. K. Herpetological Societies: 39-43, 1988
ê T. Thatcher The
Reproduction in Captivity of the North African Spiny-tailed Lizard Brit.
Herp. Soc. Bull. 40: 9-13, 1992
ê T. Wilms & W. Bôhme Revision der Uromastyx acanthinura – Artengruppe, mit Beschreibung
einer neuen Art aus der Zentralsahara (Reptilia: Sauria: Agamidae) Zoologische
Abhandlungen 2001
ê T. Wilms Dornschwanzagamen – Lebensweise, Pflege und Zucht. 2nd
edition. Herpeton-Verlag,
Offenbach. 143 pp. 2001
ê T. Wilms Uromastyx – spiny-tayled agamas Reptilia n°
21, april 2002
ê
M. Zain-ul-Abedin & B. Katorski Increased blood clotting time in a hibernating lizard Canadian
Journal of Physiology and Pharmacology vol.
44, p. 505-507, 1966
ê
M. Zain-ul-Abedin & B. Katorski Certain blood constituents of a lizard during hibernation and
activity Canadian Journal of
Physiology and Pharmacology vol. 45,
p. 115-119, 1967
ê
L. Sautereau Uromastyx
acanthinurus Aquarama n° 104 1988
ê T. Jones Captive care and breeding of the Ornate Uromastyx Reptilian 2000
ê
G. Matz, M. Vanderhaege Guide du Terrarium Delachaux et Niestle 1978, 1990
ê
U. Manthey, N. Schuster Agamid Lizards TFH 1996
ê
F. J. Obst, K. Richter, U. Jacob Atlas of Reptiles and Amphibians for the Terrarium TFH 1988
ê
J. G. Walls Uromastyx
& Butterfly Agamids TFH 1996
ê
R. G. Sprackland Giant
Lizards
TFH 1992
Sources Internet
-
J. Corzine Uromastyx: Husbandry and Breeding of
U. maliensis
-
R. L. Gray Captive reproduction of “Rainbow Benti”
Spiny-tailed Lizards (Uromastyx benti)
- M. Moyle & N. Kingston
Uromastyx Mini-FAQ Version 1.0 (1998)
-
D. Molco
& O. Ben David Uromastyx
ornatus – diet
-
E. & S.
Sorin Care Sheet for
the Genus Uromastyx
-
A.
Vanderlinden Captive breeding
update on ornate spiny tailed-lizards
-
R. Winkler,
T. Jones, J. Shanaman, E. & S. Sorin, M. Walsh, M. Fagre Hibernation, Brumation